
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:34.
- Naposledy změněno 2025-01-22 16:56.
Neutralizace zahrnuje an kysele reagující s základna nebo an alkálie , tváření sůl a voda.
Podobně se lze ptát, jaký typ reakce je kyselá zásaditá?
Kyselina-alkalická reakce je speciální případ acidobazické reakce, kde je použitou zásadou také zásada. Když kyselina reaguje s alkalickou solí (hydroxid kovu), je produktem sůl kovu a voda . Kyselo-alkalické reakce jsou také neutralizační reakce.
Podobně, co je to neutralizační reakce? A neutralizační reakce je, když kyselina a zásada reagovat za vzniku vody a soli a zahrnuje kombinaci H+ ionty a OH- ionty k výrobě vody. The neutralizace silné kyseliny a silné zásady má pH rovné 7. Tabulka 1: Nejběžnější silné kyseliny a zásady.
Lidé se také ptají, co se stane s pH během neutralizační reakce?
Neutralizace je reakce kyseliny s bází, která vede k pH směřování k 7. Je to užitečný proces, který dochází v každodenním životě, jako je léčba kyselých poruch trávení a ošetření kyselé půdy přidáním vápna. Neutralizace také pohybuje pH alkálie směrem k sedmi.
Jaké látky mohou reagovat s kyselinou za vzniku rozpustné soli?
Kov Oxidy lze také použít jako báze a nechat reagovat s kyselinami za vzniku solí a vody. Zatímco poměrně reaktivní kovy může reagovat s kyselinami za vzniku soli a vodíku, solí velmi nereaktivních kovy , jako je měď, nelze tímto způsobem vyrobit, protože tyto kovy nereagují s kyselinami.
Doporučuje:
Jak se nazývá sůl vzniklá neutralizací kyseliny chlorovodíkové a hydroxidu sodného?
Vysvětlení: Reakce mezi hydroxidem sodným (NaOH) a kyselinou chlorovodíkovou (HCl) je neutralizační reakce, jejímž výsledkem je tvorba soli, chloridu sodného (NaCl) a vody (H2O). Jde o exotermickou reakci
Jak určíte množství kyseliny potřebné k neutralizaci zásady?

Řešení problému acidobazické neutralizace Krok 1: Vypočítejte počet molů OH-. Molarita = mol/objem. mol = molarita x objem. mol OH- = 0,02 M/100 mililitrů. Krok 2: Vypočítejte potřebný objem HCl. Molarita = mol/objem. Objem = mol/molarita. Objem = mol H+/0,075 Molarita
Jak používáme kyseliny a zásady v každodenním životě?

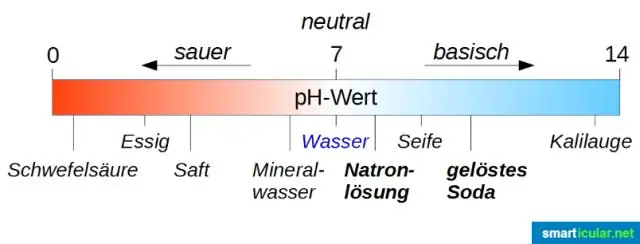
Zubní pasta a antacida jsou dobrými příklady základních produktů, zatímco potraviny jako pomerančový džus nebo pomeranče jsou vysoce kyselé. Stupnice pH. Stupnice pH se pohybuje od 1 do 14 a zobrazuje rozsah kyselin a zásad shora dolů. Zubní pasta a pH. pH potravinářských výrobků. Kyselinové neutralizační léky. Čistící prostředky
Jak testujete kyseliny a zásady?

Ponořte jeden konec modrého lakmusového papírku do roztoku a rychle jej vyjměte. Modrý lakmusový papírek testuje kyselé roztoky. Pokud je roztok kyselý, okamžitě zčervená. Zůstane modrá, pokud je roztok buď neutrální, nebo zásaditý
Jak zjistíte pH v bodě ekvivalence silné kyseliny a silné zásady?

V bodě ekvivalence se stejná množství H+ a OH- iontů spojí za vzniku H2O, což má za následek pH 7,0 (neutrální). pH v bodě ekvivalence pro tuto titraci bude vždy 7,0, to platí pouze pro titrace silné kyseliny se silnou bází
