
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:34.
- Naposledy změněno 2025-01-22 16:56.
Takže jakékoli elektronová konfigurace ve kterém a poslední elektron (znovu, a mocenství elektron ) je v A vyšší energie orbital, tento prvek je řekl, aby byl v vzrušený stav . Například když se podíváme na základní stav ( elektrony v a energeticky nejnižší dostupný orbital) kyslíku, elektronová konfigurace je 1s22s22p4.
Také víte, co to znamená základní elektronová konfigurace?
The základní elektronová konfigurace je uspořádání elektrony kolem jádra atomu s nižšími energetickými hladinami. The elektrony obsazení orbitalů různých energetických úrovní přirozeně klesá směrem k nejnižší energii Stát nebo základní stav.
Kromě výše uvedeného, jaká je elektronová konfigurace atomu Mn v základním stavu? The základní elektronová konfigurace z základní stav plynně neutrální mangan je [Ar]. 3d5. 4s2 a výraz symbol je 6S5/2.
Z toho, který z nich je v základní konfiguraci?
A přízemní - Stát atom je atom, ve kterém nelze přenosem snížit celkovou energii elektronů jeden nebo více elektronů na různé orbitaly. To znamená, že v a přízemní - Stát atom, všechny elektrony jsou v nejnižších možných energetických hladinách. např.: Uvažujme atom uhlíku, jehož elektronová konfigurace je následující.
Co je to Hundovo pravidlo?
Hundovo pravidlo . Hundovo pravidlo : každý orbital v podslupce je jednotlivě obsazen jedním elektronem, než je jeden orbital obsazen dvakrát, a všechny elektrony v jednotlivě obsazených orbitalech mají stejný spin.
Doporučuje:
Jaká je elektronová konfigurace chloru v excitovaném stavu?

Která elektronová konfigurace představuje atom chloru v excitovaném stavu? (2) 2-8-6-1 je excitovaný stav chloru, v periodické tabulce je základní stav 2-8-7. Konfigurace excitovaného stavu elektronů ukazuje, že elektron opouští jednu energetickou hladinu a pohybuje se nahoru na vyšší hladinu
Jaká je úplná elektronová konfigurace základního stavu pro atom galia?

Základní elektronová konfigurace základního plynného neutrálního gallia je [Ar]. 3d10. 4s2. 4p1 a termínový symbol je 2P1/2
Jak souvisí elektronová konfigurace s kvantovými čísly?
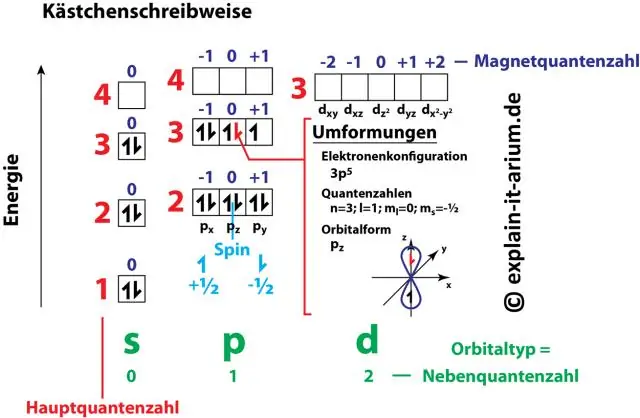
Páry čísel a písmen v elektronové konfiguraci představují dvě ze čtyř kvantových čísel elektronu. Tato kvantová čísla nám řeknou více informací o vlastnostech elektronů a jejich orbitalech. Hlavní kvantové číslo (n) nám říká energetickou hladinu elektronu a jeho velikost
Jaká je elektronová konfigurace atomu vápníku?

[Ar] 4s²
Kolik 3D elektronů je přítomno v základním stavu atomu chrómu?

Atomy chrómu mají 24 elektronů a struktura obalu je 2,8. 13.1. Základní elektronová konfigurace základního plynného neutrálního chrómu je [Ar]. 3d5
