
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:34.
- Naposledy změněno 2025-01-22 16:56.
Vezměme si příklad a vyrovnávací paměť tvořený slabým základem amoniak , NH3 a její konjugovaná kyselina, NH4+. Když HCl k tomu se přidává (silná kyselina). vyrovnávací paměť ionty H+ přidané do systému jsou spotřebovány systémem NH3 na formulář NH4+. Další přidání kyseliny nebo zásady k vyrovnávací paměť rychle změní své pH.
Podobně je nh3 a NH4Cl roztokem pufru?
Odpověď a vysvětlení: Amoniak a chlorid amonný vyrovnávací paměť je směs slabé kyseliny a její soli. Je to základní vyrovnávací paměť protože bazická disociační konstanta pro amoniak je větší než kyselá konstanta pro amonné ionty.
Podobně, jaký typ reakce je HCl a nh3? Tím pádem NH3 při obdržení H+ z HCl (H+ a Cl-) tvoří NH4+ (amonný iont), který po vazbě s Cl- iontem (z HCl ) poskytuje NH4Cl (chlorid amonný). The reakce je reprezentován jako NH3 + HCl = NH4CI.
Otázkou také je, jaká reakce nastane, když se HCl přidá do amoniakového pufru?
Kyselina chlorovodíková kyselina by prudce reagoval s amoniakem za vzniku chloridu amonného (což je velmi slabě kyselá sůl, obecně neškodná), neutralizoval by zásaditost roztoku a byla by pozorována silná tvorba bublin plynného vodíku jako šumění roztoku.
Jak vyrobíte roztok amoniaku?
Amoniak -Chlorid amonný Buffer : Rozpusťte 67,5 g chloridu amonného v cca 200 ml vody, přidejte 570 ml sil. roztok amoniaku a zředí se vodou na 1000 ml. Amoniakový pufr pH 9,5: Rozpusťte 33,5 g chloridu amonného v ISO ml vody a 42 ml 10M amoniak a zředí se vodou na 250 ml.
Doporučuje:
Které řešení je pufr?

Tlumivý roztok je takový, který odolává změnám pH, když jsou k němu přidána malá množství kyseliny nebo zásady. Kyselé tlumivé roztoky. Kyselý tlumivý roztok je jednoduše ten, který má pH nižší než 7. Kyselé tlumivé roztoky se běžně vyrábějí ze slabé kyseliny a jedné z jejích solí – často sodné soli
Která je silnější báze nh3 nebo h2o?

NH3 má tedy silnější tendenci přijímat H+ než H2O (jinak by H2O přijala proton a fungovala jako báze a NH3 by fungovala jako kyselina, ale víme, že je to báze ve H2O)
Proč pufr funguje nejlépe při pH blízkém jeho pKa?
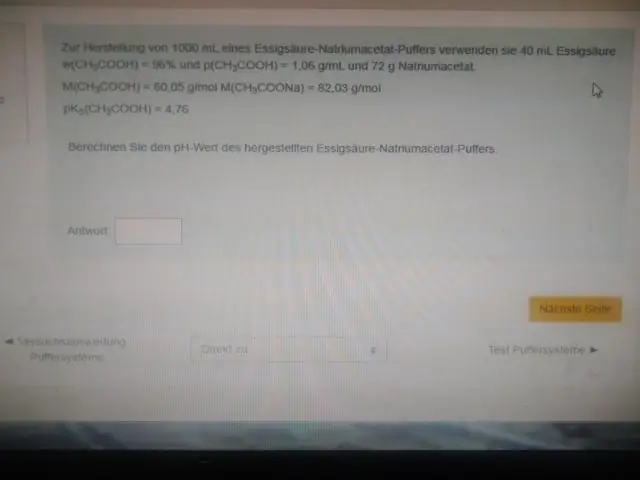
Jinými slovy, pH ekvimolárního roztoku kyseliny (např. když poměr koncentrace kyseliny a konjugované báze je 1:1) se rovná pKa. Tato oblast je nejúčinnější pro odolnost proti velkým změnám pH, když se přidá kyselina nebo zásada. Titrační křivka vizuálně demonstruje kapacitu pufru
Jak vyrobíte uhličitanový bikarbonátový pufr?

Uhličito-bikarbonátový pufr (pH 9,2 až 10,6) recept a příprava Připravte si 800 ml destilované vody ve vhodné nádobě. K roztoku se přidá 1,05 g hydrogenuhličitanu sodného. K roztoku se přidá 9,274 g uhličitanu sodného (bezvodého). Přidejte destilovanou vodu, dokud objem nebude 1 l
Může silná kyselina a slabá báze vytvořit pufr?

Jak jste viděli při výpočtu pH roztoků, k drastické změně pH je nutné pouze malé množství silné kyseliny. Pufr je jednoduše směs slabé kyseliny a její konjugované báze nebo slabé báze a její konjugované kyseliny. Pufry fungují tak, že reagují s jakoukoli přidanou kyselinou nebo zásadou, aby se regulovalo pH
